[사이언스] 생합성 필수대사체로 세포사멸 조절 기전 찾아내페롭토시스 세포사멸 표적 치료제 개발에 기여
생합성 필수대사체로 폐암, 대장암 등과 같은 암의 세포사멸을 조절할 수 있는 분자 기전이 국내 연구진에 의해 발견되었다.
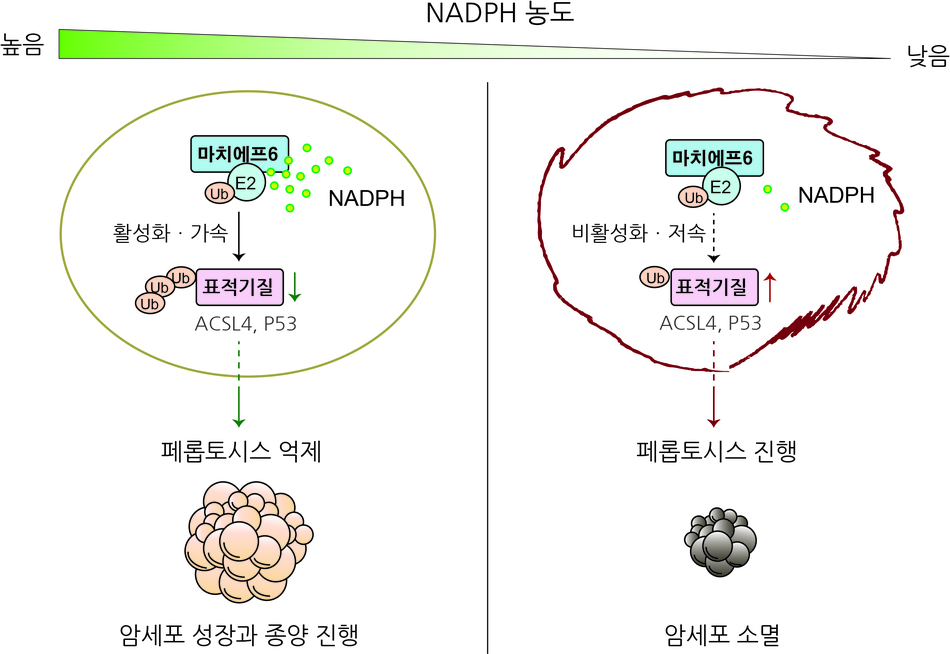
한국연구재단은 황철상, 이윤태 교수(포항공과대학교, 제1저자 응우옌 테 카 박사) 연구팀이 마치에프6 단백질이 생합성에 꼭 필요한 대사체인 NADPH를 직접 감지하고 주요 페롭토시스 유도 인자들의 분해를 조절함으로써 세포사멸을 제어한다는 사실을 규명했다고 밝혔다.
페롭토시스는 철분에 의해 과생성된 지질 과산화로 세포 속 막 구조물이 망가지면서 세포가 죽는 세포사멸 경로로써, 암세포를 죽이는 새로운 항암 치료 해법으로 주목받고 있다.
최근 연구에 따르면 필수대사체인 NADPH는 글루타티온과 코엔자임큐 등 항산화제의 재생을 돕는 역할을 하여 페롭토시스를 억제한다.
특히 NADPH의 함량이 높은 암세포들은 페롭토시스 유발 약물들에 내성을 가져 세포사멸이 유도되지 않는다. 그래서 효과적인 세포사멸 유도를 위해 세포 속의 NADPH 함량을 직접 감지하여 페롭토시스를 조절하는 인자나 분자 기전의 필요성이 제기되어 왔으나 밝혀지지 않았다.
이에 연구팀은 소포체 막에 끼어 있는 마치에프6 단백질이 세포 속 NADPH를 직접 인식하고 페롭토시스 유도 인자들의 분해를 조절해서 페롭토시스 세포사멸을 제어하는 것을 규명하였다.
폐암, 자궁암, 대장암 세포주들에서 마치에프6와 페롭토시스의 관련성을 분석한 결과 마치에프6를 결손 시킨 암세포주에서 지질과산화가 증가하고, 기존 항암제로 사용되는 페롭토시스 유발 약물들에 대한 민감도가 증가하여 내성이 있던 암세포들의 사멸을 유도하게 되었다.
반면 마치에프6를 과량 발현시켰을 때는 페롭토시스 유발 약물에 대한 암세포주들의 민감도가 오히려 감소하여 암세포들이 성장하였다. 이를 통해 마치에프6가 페롭토시스 세포사멸 제어자로서 작동 가능성을 확인하였다.
나아가 배양된 암세포주를 생쥐에 이식하여 실험을 진행한 결과, 마치에프6가 결손 된 암세포들에서 페롭토시스가 급격히 일어나, 종양형성이 현저히 억제되는 것을 밝혀내, 세포 수준에서의 실험을 동물실험으로 발전시켜 페롭토시스와 마치에프6의 생물학적 현상을 확인하고 활용 가능성도 증명하였다.
황철상 교수는 “이번 성과가 페롭토시스 세포사멸과 관련된 각종 암, 퇴행성 신경질환, 조직괴사 등의 치료제 개발을 위한 단초를 제시해 줄 것”이라고 전하며, “질병 유발 단백질을 분해ㆍ제거하는 신약 개발 플랫폼 기술에 마치에프6가 활용될 가능성을 제시”했다고 기대를 덧붙였다.
이번 연구의 성과는 세포생물학분야 국제학술지인‘네이처 셀 바이올로지(Nature Cell Biology)’에 8월 8일 게재되었다.
이 기사 좋아요
<저작권자 ⓒ 특허뉴스 무단전재 및 재배포 금지>

댓글
생합성,필수대사체,세포사멸,페롭토시스,폐암,대장암,암세포,종양, 관련기사목록
|
많이 본 기사
|